SUPERA KVALITETA pruža usluge poslovnog savjetovanja za aktivnosti vezane za:
validaciju računalnih sustava, validaciju malih aplikacija, validaciju čišćenja, validaciju procesa, kvalifikaciju opreme
 Validacija informacijskih, laboratorijskih i procesnih sustava i održavanje računalnih sustava u validiranom stanju u skladu s važećim smjernicama i vodičima: EU GMP Annex 11, ISPE GAMP 5, FDA 21 CFR Part 11 (za sustave koji koriste elektroničke zapise i potpise) obuhvaća aktivnosti:
Validacija informacijskih, laboratorijskih i procesnih sustava i održavanje računalnih sustava u validiranom stanju u skladu s važećim smjernicama i vodičima: EU GMP Annex 11, ISPE GAMP 5, FDA 21 CFR Part 11 (za sustave koji koriste elektroničke zapise i potpise) obuhvaća aktivnosti:
- pomoć u izradi i/ili pregled validacijske dokumentacije za sve faze životnog ciklusa računalnog sustava (planiranje, specifikacije, razvoj, kvalifikacija instalacija, kvalifikacija operacija, kvalifikacija rada, puštanje sustava u rad)
- pomoć u izradi potrebnih uputa (SOP - Standard Operating Procedure)
- analizu rizika
- audit dobavljača
- provođenje edukacije
 Pružamo i podršku za izradu i validaciju malih aplikacija (Access, Excel, FileMaker) koje se koriste u GxP okruženju a koji moraju biti validirani.
Pružamo i podršku za izradu i validaciju malih aplikacija (Access, Excel, FileMaker) koje se koriste u GxP okruženju a koji moraju biti validirani.
 Također pružamo usluge podrške za usklađivanje sustava, računalnih sustava i procedura sa zahtjevima za integritet podataka u skladu s važećim smjernicama.
Također pružamo usluge podrške za usklađivanje sustava, računalnih sustava i procedura sa zahtjevima za integritet podataka u skladu s važećim smjernicama.
 Validacija čišćenja - svrha validacije čišćenja je potvrditi da je postupak čišćenja učinkovit te osiguravanje neškodljivost lijeka sprečavanjem unakrsne kontaminacije.
Validacija čišćenja - svrha validacije čišćenja je potvrditi da je postupak čišćenja učinkovit te osiguravanje neškodljivost lijeka sprečavanjem unakrsne kontaminacije.
Validacija čišćenja i održavanje validiranog statusa u skladu s važećim smjernicama i vodičima: EU GMP Vol 4. Part I i Part II, EU GMP Annex 15, PIC/S PI 006, APIC Guidance on aspects of cleaning validation in active pharmaceutical ingredient plants, FDA Guide to inspections validation of cleaning processes, ICH Guidelines, VICH Guidelines, obuhvaća aktivnosti:
- pomoć u izradi i/ili pregled validacijske dokumentacije (osnovni validacijski plan - validation master plan (VMP), protokol za validaciju čišćenja, izvješće o validaciji čišćenja, opisi postupaka čišćenja - SOP-ovi, radne upute i dr.)
- pomoć u izradi matrice opreme proizvoda i grupiranju proizvoda
- pomoć oko postavljanja kriterija prihvatljivosti i izračuna granica za ostatak proizvoda
- analizu rizika
- provođenje edukacije
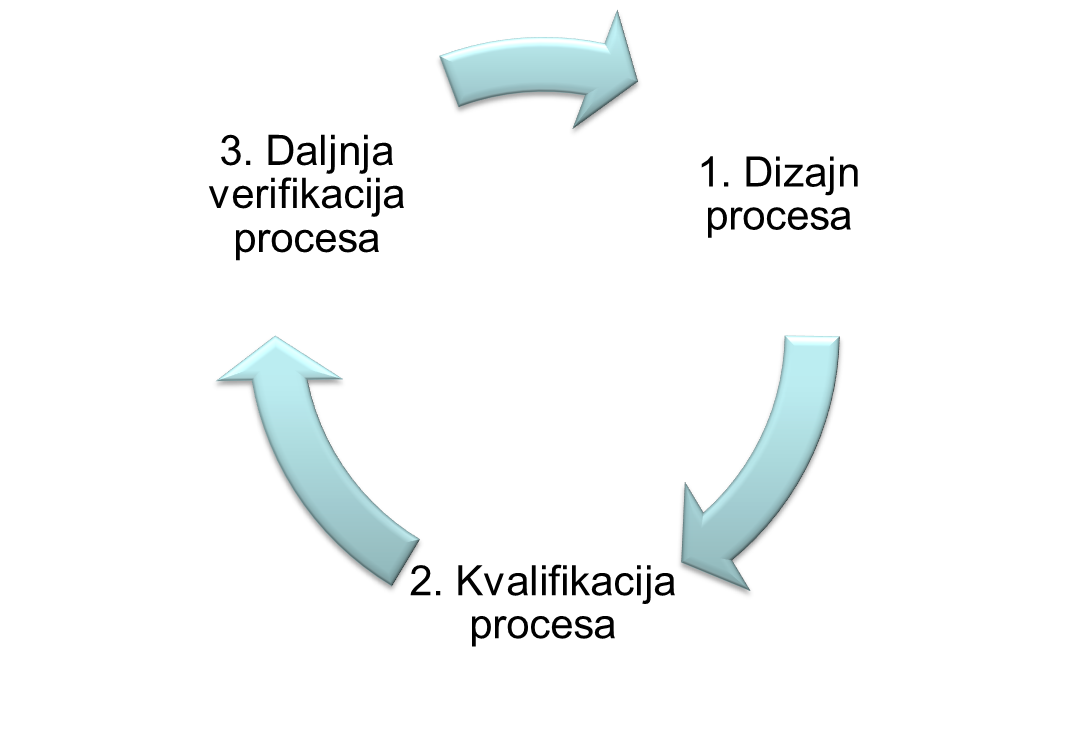
Validacija procesa - dokumentirani dokaz da proces koji se vodi unutar postavljenih parametara može učinkovito i ponovljivo proizvesti proizvod koji je u skladu s unaprijed određenim specifikacijama i obilježjima kvalitete.
Validacija procesa u skladu s važećim smjernicama i vodičima: EU GMP Annex 15, EU GMP Chapter 5, EMA Guideline on Process Validation, FDA Guidance for Industry Process Validation, obuhvaća aktivnosti:
- pomoć u izradi i/ili pregled validacijske dokumentacije (osnovni validacijski plan - validation master plan (VMP), validacijski protokol (plan validacije), validacijsko izvješće)
- analizu rizika
- savjetovanje iz područja suvremenih pristupa razvoju i validaciji procesa: Quality by Design (QbD), Process Analytical Technology (PAT), Continued Process Verification
- provođenje edukacije
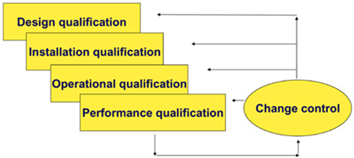 Kvalifikacija opreme - postupak kojom se dokazuje i dokumentira da oprema ispravno funkcionira te da stvarno dovodi do očekivanih rezultata.
Kvalifikacija opreme - postupak kojom se dokazuje i dokumentira da oprema ispravno funkcionira te da stvarno dovodi do očekivanih rezultata.
Kvalifikacija opreme u skladu s važećim smjernicama i vodičima: EU GMP Vol 4. Part I i Part II, EU GMP Annex 15, EMA Guideline on Process Validation, PIC/S PI 006, WHO Annex 4 - Appendix 6, FDA Guidance for Industry Process Validation, obuhvaća aktivnosti:
- pomoć u izradi i/ili pregled kvalifikacijske dokumentacije (specifikacija korisničkih zahtjeva (User Requirements Specification - URS), kvalifikacija dizajna (Design Qualification – DQ), testiranje prihvatljivosti kod isporučitelja (Factory Acceptance Testing - FAT), testiranje prihvatljivosti na mjestu korištenja (Site Acceptance Testing - SAT), kvalifikacija instalacija (Installation Qualification - IQ), kvalifikacija operacija (Operational Qualification – OQ), kvalifikacija rada (Performance Qualification – PQ)
- analizu rizika
- provođenje edukacije
O validaciji računalnih sustava, validaciji malih aplikacija, integritetu podataka, validaciji čišćenja i dr. možete saznati više na našim seminarima otvorenog tipa - informacije potražite na rasporedu seminara otvorenog tipa
